در مطلب قبلی در رابطه با داروهای جدید با پپتید محدود شده صحبت کردیم و در این مطلب از شرکت دایا اکسیر فروش مواد شیمیایی آزمایشگاهی، می خواهیم به بررسی تیتراسیون بپردازیم.
فهرست مطالبی که در ادامه به آنها پرداخته شده است:
تیتراسیون چیست؟
تیتراسیون که به عنوان تیتر سنجی نیز شناخته می شود یک تکنیک تجزیه و تحلیل کیفی شیمیایی است که برای محاسبه غلظت یک آنالیت معین استفاده می شود. تیتراسیون یک تکنیک مهم در زمینه شیمی تجزیه است و گاهی اوقات به عنوان آنالیز حجمی نیز شناخته می شود.
روش های تیتراسیون
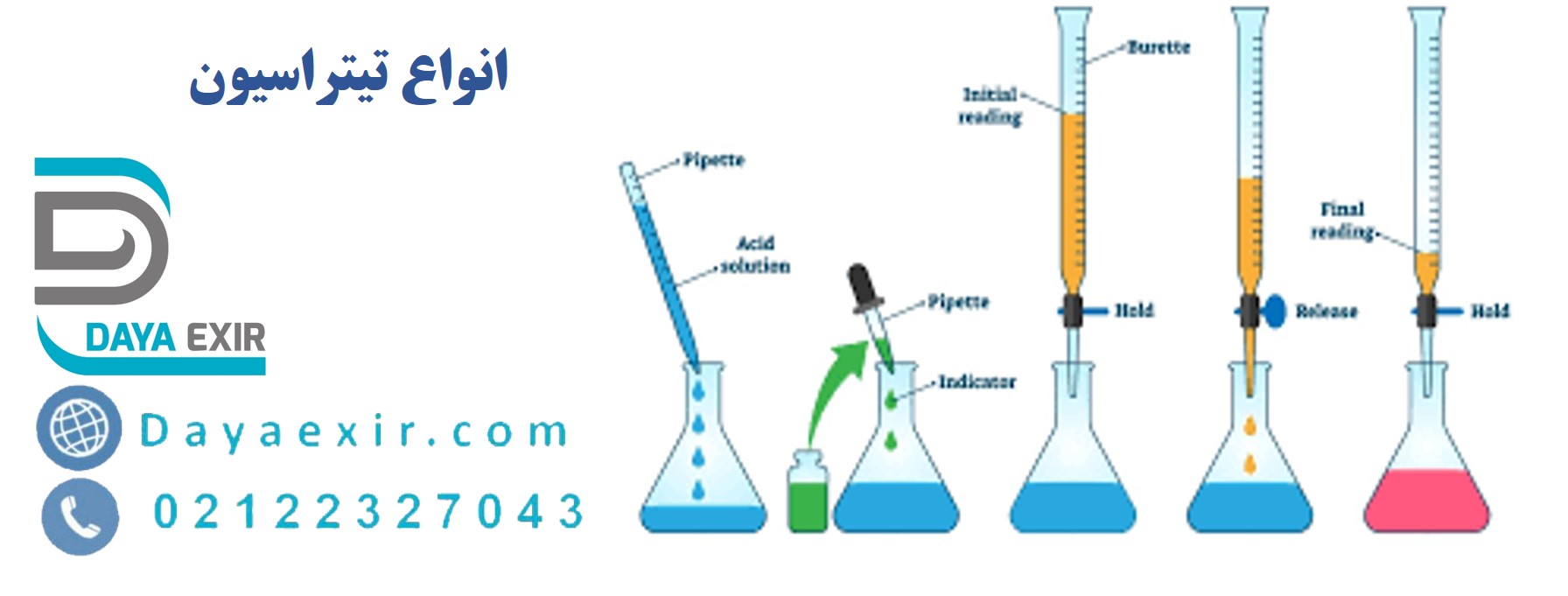
فرآیند تیتراسیون شامل تهیه تیترانت یا تیتراتور یک محلول استاندارد است که حجم و غلظت آن از قبل تعیین شده است. سپس این تیتراتور با آنالیت واکنش نشان می دهد تا زمانی که به نقطه پایانی یا هم ارزی برسد، در این مرحله می توان غلظت آنالیت را با اندازه گیری مقدار تیتر مصرفی تعیین کرد. روش دیگر، Titration استوکیومتری است که برای یافتن غلظت مجهول یک محلول استفاده می شود.
در مورد مراحل این روش، مقدار بسیار دقیقی از آنالیت در یک فنجان یا ارلن مایر اضافه می شود. مقدار کمی معرف (مانند فنل فتالئین) در زیر یک بورت کالیبره شده و حجم های کمی از تیترانت به آنالیت و نشانگر اضافه می شود. این کار تا زمانی ادامه می یابد که نشانگر در واکنش به اشباع شدن تیترانت تغییر رنگ دهد.
این مرحله، نشان دهنده این است که به نقطه پایانی Titration رسیده ایم.
تیترانت و آنالیت باید به صورت مایع (محلول) باشند. در بیشتر تیتراسیونهای غیر اسید-باز، یک pH ثابت مورد نیاز است که برای این کار، یک محلول بافر به محفظه تیتراسیون اضافه می شود تا pH حفظ شود.
انواع تیتراسیون
تیتراسیون ها را می توان به شکل های زیر طبقه بندی کرد:
- اسید و باز
- ردوکس
- فاز گاز
- کمپلکسومتری
- پتانسیل زتا
- سنجش
- اکسیداسیون با استفاده از KMnO4
- یدومتری
اسید-باز
این روش عمدتاً به خنثی شدن بین اسید و باز هنگام مخلوط شدن در محلول بستگی دارد. به طور قابل توجهی، قدرت یک اسید با استفاده از محلول استاندارد یک باز تعیین می شود. به این فرآیند اسید سنجی نیز می گویند.
روش اسید و باز
حجم مورد نیاز از پایه گرفته می شود که غلظت آن مشخص است در یک پیپت و در فلاسک تیتراژ ریخته می شود.
اسیدی که غلظت آن ناشناخته است در بورت گرفته می شود و اجازه می دهد قطره قطره با باز واکنش دهد.
شاخصی که برای تشخیص نقطه پایانی استفاده می شود نیز در فلاسک تیتراسیون اضافه می شود.
هنگامی که واکنش به پایان می رسد، رنگ محلول در فلاسک تیتراسیون به دلیل وجود نشانگر تغییر می کند.
شاخص مورد استفاده برای این منظور می تواند فنل فتالئین باشد که در محلول بازی رنگ صورتی و در محلول اسیدی بی رنگ و محلول خنثی است.
بنابراین نقطه پایانی زمانی شناسایی می شود که محلول صورتی رنگ بی رنگ شود.
چگونه یک شاخص برای Titration اسید و باز انتخاب کنیم؟
هنگامی که اسید بسیار ضعیف است، تشخیص یا به دست آوردن نقطه پایانی دشوار است. برای این منظور، نمک اسید ضعیف را در برابر اسید قوی تیتر می کنند، زیرا باز مزدوج اسید ضعیف، یک باز قوی است.
به عنوان مثال: CH3COOH یک اسید ضعیف است. اما CH3COONa یک پایه قوی است.
شاخص های مورد استفاده در این مورد می تواند متیل رد یا متیل نارنجی باشد که در محلول اسیدی نارنجی و در محلول های بازی و خنثی زرد است.
اگر نمک اسید ضعیف و باز ضعیف مانند غلظت کربنات آمونیوم باید مشخص شود، بسته به نمک، می توان آن را در برابر یک اسید قوی یا یک باز قوی تیتر کرد.
تیتراسیون ردوکس
در اینجا، علاقه به یافتن غلظت ناشناخته یک عامل کاهنده یا اکسید کننده است. عوامل اکسید کننده یا کاهنده به ترتیب در برابر عوامل احیا کننده یا اکسید کننده قوی تیتر می شوند. در بیشتر Titrations ردوکس، یکی از واکنشدهندهها بهعنوان یک نشانگر عمل میکند و رنگ آنها را با حالتهای اکسیدکننده تغییر میدهد.
ردوکس به عنوان یک واکنش اکسیداسیون – احیا نیز شناخته می شود یک واکنش شیمیایی است که بیشتر با انتقال الکترون در یون های واکنش دهنده محلول های آبی رخ می دهد.
تیتراسیون فاز گاز
اینها تیتراسیونهایی هستند که در فاز گاز انجام میشوند، بهویژه به عنوان روشهایی برای تعیین گونههای واکنشپذیر از طریق واکنش با مقداری گاز دیگر که به عنوان تیترکننده عمل میکنند.
تیتراسیون کمپلکسومتری
کمپلکسومتری عمدتاً به تشکیل کمپلکس بین آنالیت و تیترانت بستگی دارد.
تیتراسیون پتانسیل زتا
پتانسیل زتا آنهایی هستند که تکمیل واکنش توسط پتانسیل زتا، به جای یک نشانگر، به منظور مشخص کردن سیستمهای ناهمگن، مانند کلوئیدها، کنترل میشود.
سنجش
سنجش نوعی تیتراسیون بیولوژیکی است که عمدتاً برای تعیین غلظت یک ویروس یا باکتری استفاده می شود.
در مواردی هم Titration می تواند بیش از یک جزء داشته باشد (به عنوان مثال واکنش Na2CO3 + NaHCO3). بنابراین، بر اساس تعداد اجزای تیتر، تیترها را می توان به صورت زیر تقسیم کرد.
- Single Titration
- Double Titration
تیتراسیون ها بیشتر بر اساس معرف استفاده شده نامگذاری می شوند مانند تیتراسیون
KMnO4، تیتراسیون یدومتری
تیتراسیون اکسیداسیون با استفاده از KMnO4
KMnO4 یک عامل اکسید کننده قوی است که تقریباً هر عامل کاهنده رایج دیگری را اکسید می کند. رنگ آن بنفش است و با Mn2+ به بی رنگ تغییر می کند. و هنگامی که MnO2 تشکیل می دهد به رنگ سیاه تبدیل می شود.
تیتراسیون یدومتری (روش مستقیم)
در این روش از محلول ید (I2) برای Titration عوامل کاهنده استفاده می شود.
الزامات اساسی برای تیتراسیون
تیتر یا آنالیتیک: محلولی است که غلظت آن مشخص نیست
تیترانت: محلولی است که غلظت آن مشخص است.
محلول استاندارد: تیترانت در واقع از محلول استانداردی که غلظت آن مشخص است گرفته می شود. بسته به نحوه تهیه آنها می توانند دو نوع باشند.
استاندارد اولیه
این با حل کردن مقدار اندازه گیری شده املاح، حجم اندازه گیری شده آب به طور مستقیم تهیه می شود. به عنوان مثال سولفات آمونیوم آهن و غیره.
استاندارد ثانویه
این با تیتر کردن یک محلول در برابر محلول استاندارد اولیه KOH، NaOH یا هر محلول دیگری که نمی تواند برای مدت طولانی تری ذخیره شود، تحت استاندارد ثانویه تهیه می شود.
یک راه حل استاندارد باید معیارهای زیر را برآورده کند.
خلوص نمونه باید به طور ایده آل ۱۰۰٪ باشد.
در دمای اتاق پایدار است
تمرکز نباید در یک دوره زمانی تغییر کند
باید جرم مولکولی بالایی داشته باشد. این محاسبات بدون خطا را می دهد.
تیتراسیون آنالیز وزنی
این کار برای عناصری انجام می شود که می توانند نمک های نامحلول را در محلول آبی تشکیل دهند. این شامل جداسازی یون ها از ترکیب به شکل رسوب است. در زیر مراحل مربوط به این فرآیند آمده است.
نمونه ای به مقدار مشخص گرفته می شود و جزء مورد نیاز در نمونه به رسوب تبدیل می شود.
این رسوب خالص شده و آزمایش می شود و نتیجه مورد نیاز (غلظت یا خلوص نمونه) به دست می آید.
نقاط پایانی یا هم ارزی
این مرحله ای است که واکنش به پایان می رسد. نقاط پایانی یا نقاط هم ارزی را می توان به عنوان نقطه ای در واکنش ها تعریف کرد.
برای تشخیص نقطه پایانی، بیشتر زمان SP و “Indicator” استفاده می شود. شاخص مورد استفاده به نوع واکنش بستگی دارد.
به عنوان مثال: فنل فتالئین یا متیل اورانژ را می توان برای روشTitration اسیدها و بازها استفاده کرد. اندیکاتورها با تغییر رنگ خود در نقطه پایانی نقطه پایانی را نشان می دهند، گاهی اوقات یکی از واکنش دهنده ها می تواند به عنوان یک نشانگر عمل کند.
معادله اسکلتی واکنش باید شناخته شود.
واکنش نباید خیلی آهسته یا سریع باشد تا محاسبات عاری از خطا باشد.
نقطه پایانی (تکمیل) واکنش باید به راحتی قابل تشخیص باشد. برای این منظور از شاخص هایی استفاده می شود که بعداً مورد بحث قرار می گیرد.
هیچ واکنش جانبی نباید وجود داشته باشد. اگر چیزی وجود دارد که واکنش های جانبی را تشکیل می دهد، آن جزء خاص باید قبل از فرآیند Titration حذف شود.
بررسی منحنی تیتراسیون
منحنی تیتراسیون جایی است که pH محلول آنالیت را در مقابل حجم تیترانت اضافه شده با پیشرفت تیتراسیون رسم می کنیم. در یک منحنی تیتراسیون، مختصات x آن حجم تیترانت اضافه شده از ابتدای Titration را نشان می دهد. مختصات y نشان دهنده غلظت آنالیت در مرحله مربوط به Titration است. در روش اسید-باز، منحنی تیتراسیون بیشتر نشان دهنده قدرت اسید و باز مربوطه است.
سخن پایانی
در این مطلب از دایا اکسیر به تعریف و انواع تیتراسیون، روش های آن، الزامات اساسی، آنالیز وزنی، نقاط هم ارزی و پایانی و بررسی منحنی تیتراسیون پرداختیم.